世界最先端クラスの計測装置・システム
微生物迅速検査装置Lumioneは,微生物1個に含まれる10−18 molという極めて少量のアデノシン三リン酸を測定することで,微生物の有無を検出する装置である。現在広く用いられている寒天培養法とは異なり,培養なしで測定することで最速1時間の迅速性を達成している。医薬品の製造に使用される水は微生物検査が義務づけられており,従来の培養法では検査に7日間を要していたが,本装置を使用することにより1時間に短縮することが可能になる。これにより,製薬用水設備の立ち上げ期間を短縮し,医薬品生産設備の稼働率向上や異常時における影響範囲の最小化,早期の原因特定などを実現するとともに,医薬品製造のリスク管理と品質向上に寄与すると考える。





医薬品製造における微生物試験としては培養法が広く用いられているが,試験結果が得られるまでには数日から十数日を要している。これにより,多くの製薬メーカーでは出荷までに2〜4週間,医薬品を保管しており,保管費用やキャッシュフローなどが経営課題である。また,異常が発生した場合はすでに製造設備などの洗浄が終わっているために微生物混入ルートの確定が困難になるなど,品質管理の観点からも大きな課題となっている。この課題を解決する手段として,さまざまな微生物迅速法が提案されており,固相またはフロー方式のサイトメトリーなどの直接法と,免疫法,核酸増幅法,生物発光法,蛍光法,インピーダンス法,ガス測定法,質量分析法などの間接法が提案されている。現在,市場で受け入れられている迅速法は,短期培養と高感度検出(例えば,生物発光法や蛍光法)の組み合わせであるマイクロコロニー法である。この方法は,培養法をベースとしていることから,従来の平板または液体培養法と相関性が高く,新規検査法を導入する際に必要なバリデーションが容易な利点がある。現状でも,培養法で7日を要する検査を3日で行うなど,日単位での検査期間短縮は可能であるが,さらなる迅速化が求められている。一方,生物発光法,サイトメトリー法,核酸増幅法などは時間単位の迅速性を有するものの,一般的には10〜100 CFU(Colony Forming Unit:寒天培養で1個のコロニーを形成する単位。微生物1個に相当)レベルの感度であることから培養法と同等レベルでの微生物管理は困難であった。
日立が開発した微生物迅速検査装置 Lumione BL-2000(以下,「Lumione」と記す。)(図1参照)は,アデノシン三リン酸(ATP:Adenosine Triphosphate)生物発光法を利用して微生物中のATPを培養しないで測定することにより,時間単位の迅速性と1 CFUレベルの高感度を両立した。本稿では,その詳細を紹介する。
図1|Lumione BL-2000の装置外観 2018年6月に発売した微生物迅速検査装置Lumione BL-2000の外観を示す。
2018年6月に発売した微生物迅速検査装置Lumione BL-2000の外観を示す。
ATP生物発光法は,すべての生物細胞に共通して存在するATPをルシフェリン/ルシフェラーゼ反応による発光で検出する方法であり,約100年前に発見された歴史ある反応である。
この原理から,蛍光検出法などで問題となる微生物以外の微粒子の誤検出がATP法では発生しない利点がある。一方,操作者由来のATP混入,サンプルに生物物質が含まれる場合などにはATPを分解消去する対策が必要である。
微生物に含まれるATP量は10‐18 mol(amol)と極めて少量であり,菌種や菌体の状態によってもさまざまな値になる。ちなみにamolという量は,琵琶湖に小さじ3分の1程度の塩を入れた時の塩分の変化量に相当するほど微量である。
実際に微生物に含まれるATPの量は,細胞サイズの大きい酵母などでは,1 CFU当たり数百アトモルであるのに対して,内包量の少ないグラム陰性菌では,1 amol前後であることが知られている1)。
したがって,培養法と同等の1 CFUレベルで微生物を管理するためには,ATP量として1 amolの検出感度が必要であると考えられる。しかし,従来のATP法の検出感度は102〜103 CFU程度2)(ATP量として102〜103 mol程度)であり,1 CFUレベルの微生物管理は困難であった。そこで,以下の技術を開発することにより,高感度化を検討した。
ルシフェリン/ルシフェラーゼ反応によるATP発光は,ATPを含むサンプルと発光試薬が反応した直後に最大の発光を示し,その後速やかに減衰する。開発したLumioneは発光試薬を自動分注する機構を持ち,発光のリアルタイム計測が可能であることから,反応開始直後の最も高い発光量を再現性よく検出することが可能である。また,発光をむだなく検出する光学系のレイアウトおよび信号処理技術を用いたSN(Signal-noise)比の向上を図っている。さらに,試薬メーカーとの共同開発により,amolレベルの微量領域に最適化した専用試薬を開発し,使用する器材に関しては製造工程におけるATPの混入を防止する製造工程を確立することで,ATPバックグラウンドを低減している。
図2にATP濃度0〜10 amolの範囲における検量線の例を示す。検量線から得られた傾きの値を日本薬局方(医薬品に関する規格基準書)に示された算出式3)から求めた結果,検出下限は0.3 amolであった。したがって,Lumioneは1 CFUレベルで微生物を管理することに必要な1 amol未満の検出感度を有することが確認できた。
図1に示すようにLumioneは,計測部,制御部,制御用PCから構成されている。サンプルを測定する計測部は,微生物安全キャビネットまたはクリーンブース内に設置する可能性があるため,制御に関する部分からは独立した構造とした。
また,医薬品製造に関わるコンピュータは所期の目的どおり正常に作動することを検証するCSV(Computerized System Validation)が,国内では厚生労働省からのガイドライン,米国では食品医薬品局から発効されたCFR(Code of Federal Regulations)21 Part11,EU(European Union)ではEU薬事規則第11章(Annex 11)などで求められている。LumioneのソフトウェアはCSVに対応するために,ユーザー別権限の付与,ログイン履歴管理,監査証跡の検索・保存・出力機能,データの改ざん防止・バックアップ・リストア機能を有している。
医薬品の製造は,薬事法により定められた日本薬局方を順守しなければならない。この中で,医薬品の製造に使用する水(製薬用水)は,微生物の存在を一定基準以下に管理することが定められている。具体的には,製薬用水製造の原水となる常水は1 ml当たり100 CFU未満,錠剤の製造や生産設備の洗浄などに使用する精製水は1 ml当たり100 CFU未満,注射剤の製造などに使用する注射用水は100 ml当たり10 CFU未満になるように微生物管理する必要がある。日本薬局方には,最も標準的な製薬用水の微生物管理方法として,製薬用水を平面フィルタでろ過し,1または2種類の寒天培地上で,4〜7日間培養する方法(フィルターメンブレン法)が記載されている。したがって,多くの製薬メーカーでは,医薬品製造後7日以降に微生物試験の結果を確定している。
これに対して,2016年3月に告示された第十七改正日本薬局方に「微生物迅速試験法」が新規に収載された。これは医薬品製造における微生物管理に使用可能な迅速法を示すとともに迅速法導入に必要なバリデーションに関する基本的な考え方が示されており,迅速法の普及を促進する目的で収載されたものである。ATP法も迅速法として収載されたことから,日本薬局方に準拠した方法となり,製薬メーカーが安心して導入できる環境が整った。
図3に製薬用水を検査対象とした検査工程を示す。従来の培養法と同じ方法で採取したサンプルをLumione専用のフィルタアッセンブリを使用して吸引ろ過する。本フィルタアッセンブリに100 ml用ファンネル(漏斗)を装着して使用することで,製薬用水100 mlを10分以内にろ過可能である。ろ過後,フィルタには生菌や死菌,または混入したATPなどが捕捉される。微生物検査は生きた微生物の検出を目的としているため,死菌ATPおよび混入ATPを分解消去する必要がある。また,微生物の中には生育が困難な環境では芽胞と呼ばれる種子のような休眠状態になるものが存在し,この芽胞からはATPを抽出することが困難である。この問題を解決する方法として,芽胞を発芽させることでATP抽出が可能な状態に変化させることを目的に,Lumione専用試薬キットに含まれる発芽・消去液を使用する。本液をフィルタ内に添加後,37℃で40分間ブロックヒータでインキュベーションを実施することにより,ATP分解消去と発芽を同時に進行することができる。その後,洗浄液でリンスして遠心ろ過により残液を除去する。Lumione専用計測チューブにフィルタを乗せ,フィルタ内に抽出液を添加し,室温で5分間静置後,遠心ろ過により抽出液を計測チューブに回収する。この計測チューブを計測チューブラックにセットしてLumioneに設置し,1サンプル当たり5分間で発光計測を実施する。
以上の工程により,製薬用水100 ml中の微生物を最速1時間で検出することが可能である。
本検査工程で注射用水中の微生物を検出した場合の1 CFU当たりのATP内包量を測定した例を図4に示す。日本薬局方の参考情報に記載されている製薬用水の品質管理および医薬品の無菌試験に使用する培地の性能試験にあたって指定された合計9種類の微生物を対象とした。ATP内包量は,同一のサンプルを培養法とATP法で測定し,ATP法で得られたATP量を培養法で得たコロニー数で除した値である。
ATP内包量は,最も少なかったグラム陰性桿(かん)菌Methylobacterium extorquensで約1 amol/CFU,最も多かった酵母Candida albicansで約100 amol/CFUであった。また,その他の微生物に関しても参考文献1)に記載されたATP内包量と同様の値であった。これらの結果から,検出感度が1 amolであれば,1 CFUレベルの検出が可能なことが示された。
実際に製薬用水の微生物検査へ迅速法を導入するためには,第十五改正日本薬局方に掲載された医薬品の分析/検査に求められる「分析法バリデーション」3)に準じた検証が必要である。求められる項目は,真度,精度,特異性,検出限界,定量限界,直線性,範囲,頑健性であるが,真度に関しては,ATP法が必要とするamolレベルの測定法が存在しないため実施不可能と判断した。
精度試験には,専用試薬キットに含まれる抽出液[ネガティブコントロール(NC:Negative Control)としても使用]とATP100 amol/50 μLを含有するポジティブコントロール(PC:Positive Control)を使用した。実際の運転時適格性評価として実施した並行精度の例を表1に示す。NCの範囲は,‐0.1〜0.1 amol,PCは相対標準偏差CV(Coefficient of Variation)3%と良好な再現性を示し,判断基準を満たした。また,直線性に関して実施した例を図5に示す。0〜5,000 amolの範囲で試験した結果,相関係数 0.9998と良好な直線性を示した。また,高濃度の5,000 amolにおける並行精度も相対標準偏差CV約3%と低濃度の100 amolと同等であり,濃度による差は認められなかった。これによって,Lumioneは医薬品製造に用いる分析法として使用されるにふさわしい性能を持つことを実証した。
次に,実際の製薬メーカーで使用されている製薬用水をサンプルとして,培養法と比較した例を図6に示す。常水および精製水を同じサンプリングポイントから6サンプル採水し,培養法とATP法でそれぞれ3サンプル測定した。常水中には,培養法で約70 CFUの微生物が検出され,ATP法では約500〜1,000 amolのATPが検出された。ATP法でばらつきが大きかった原因は,サンプル中に含まれる微生物の種類がサンプルごとに異なったためと考えられる。精製水についても同様に測定した結果,培養法でコロニーは認められず,ATP法では‐0.1〜0.1 amolと検出限界以下であった。培養法とATP法は同様の結果となり,Lumioneが製薬用水の微生物管理に使用できることが確認できた。
一方,ATP発光法は菌体を破壊する検査であり,検査後に微生物同定試験を同一サンプルから実施することができない。この点に対しては,サンプリング時に従来の培養法を再試験可能な量を採水する,または,改めてサンプリングを実施し,従来の培養法を実施する。これにより,微生物混入の再現性を確認するとともに,再現した場合には従来と同じ微生物同定試験を実施する。Lumioneによる微生物試験の所要時間は1時間程度であるため,タイムラグは数時間以内であり,運用上は問題ない範囲と考えられる。
Lumioneの特長である時間単位の迅速性を生かすことを目的に,医薬品製造の中間工程管理への適用,例えば最終滅菌工程前の微生物管理などを想定して,医薬品を対象とした測定結果を表2に示す。なお,検査工程は図3に示した製薬用水検査フローに準じているが,サンプル由来成分の影響を排除するためにサンプルろ過後にリン酸緩衝液(PBS:Phosphate Buffered Saline)による洗浄工程を追加している。透析液,凍結乾燥医薬品,輸液,アンプル剤などを測定した結果,サンプルに由来するATP量は1 amol未満となり,サンプル中に含まれるATPバックグラウンドは無視できる範囲であった。特に,アミノ酸やブドウ糖などATPが混入しやすい成分を含む輸液でも,ATPバックグラウンドを無視できる範囲に抑えることができた。また,バイオ医薬品に関しても,最終滅菌前など精製された状態であれば,培養細胞由来のATPは影響しないことを確認できた。
次に,Bacillus subtilisの芽胞を指標菌として添加し,サンプル由来成分による阻害なしに検査可能かを検討した。透析液などpHが酸性またはアルカリ性に偏っている場合でも,ATP含有量は製薬用水中の測定値2 amol/CFU(図4参照)と同等であり阻害は認められなかった。また,微生物の生育を阻害する抗生物質も製薬用水と同等のATP含有量であり,阻害は認められなかった。
以上,ろ過可能な医薬品に関してさまざまな成分を検討した結果,培養法と同様に1 CFUレベルの微生物管理が可能なことが示唆された。ただし,実際に医薬品の微生物管理に本ATP法を導入する際には,個別の医薬品に対して検証する必要がある。
表2|医薬品(輸液,透析液,注射液)の微生物検査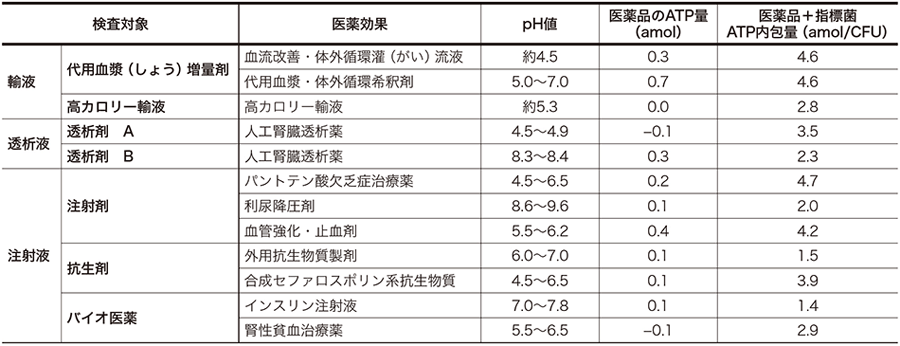 実際の医薬品をサンプルとして,微生物の存在を検出可能かを試験した結果を示す。
実際の医薬品をサンプルとして,微生物の存在を検出可能かを試験した結果を示す。
ATP法を抗菌性試験や殺菌/消毒効果試験に応用した例を示す。これらの試験は,試験対象に既知の微生物を添加し,その微生物の発育阻止や微生物の減少値で効力を評価する試験である。この試験における微生物濃度は高濃度であり,これまでの高感度検出は必ずしも必要ではない。そこで,図7に示すように前処理の簡便な溶液混合法を採用した。本方法は,試料溶液にLumione専用試薬キットに含まれる洗浄液を添加し,30分間インキュベートして菌体外ATPを消去した後,抽出液を添加して菌体内ATPを抽出し,Lumioneにて発光計測を実施する方法である。
顧客提供の消毒薬の消毒効果試験を実施した例を図8に示す。消毒薬は,0,0.1,1,10 ppmの濃度に調整し,Candida albicansを7.8×104 CFU/ml添加した。4時間経過後,培養法は希釈系列を作製して寒天培地で培養して生菌数を測定し,ATP法は溶液混合法でATP量を測定して,それぞれの結果から,添加した菌が4時間後に何桁減少したかを示す対数減少率を算出した。
同図に示すグラフのとおり,ATP法は消毒成分の濃度が低いほど,培養法と同様に対数減少率が低い傾向を示した。ATP法と培養法で対数減少率に差が認められるが,これは,培養法が増殖可能な生菌を検出する手法であるのに対し,ATP法では増殖不可能な生菌も検出することが原因と推測される。
抗菌性試験や殺菌/消毒効果試験にATP法を用いる利点は,試験結果が当日に得られる迅速性とサンプル処理の簡便性である。特にサンプル処理に関して,培養法では,1シャーレ当たりの菌数を適切な菌数にするために,1サンプルから希釈系列を作製し,各濃度をそれぞれ複数のシャーレで培養してコロニーカウントする煩雑な作業が必要である。これに対して,ATP法は3〜4桁程度の直線性があるため希釈系列は不要であり,マイクロチューブ1本で試料調製が可能である。
Lumioneは,時間単位の迅速性と1 CFUレベルの高感度を両立した微生物迅速検査装置であることが確認できた。今後は,製薬業界におけるATP法の普及に努めるとともに,高い需要のある食品/飲料業界や再生医療業界に対しても,前処理法の改良によりサンプル由来ATPの影響を排したアプリケーションを開発して検査期間の短縮や品質向上などに貢献していく。
製薬用水サンプルの提供およびバリデーションに関する意見・助言を頂いた塩野義製薬株式会社CMC研究本部の関係各位,医薬品の購入に協力いただいた日立総合病院の関係各位に深く感謝の意を表する次第である。