根本治療を可能にする再生医療とそれを支える自動培養技術
ハイライト
再生医療は,治療が難しい疾病にも根本治療の道をひらく革新的な医療として期待されている。再生医療を普及させるために,日立では治療用細胞の自動培養技術を,アカデミア,製薬企業と共にオープンイノベーションで開発してきた。
本稿では,日立の自動培養技術の特長である閉鎖系の導入により,治療用の細胞製品を高い安全性を担保しながら合理的なコストで提供できるというメリットを解説するとともに,現在取り組んでいる,細胞の状態に合わせた最適な培養を実現するインテリジェント自動培養技術について述べる。

1. はじめに
再生医療は1993年に初めてその概念が提唱1)されて以来,さまざまな難治性疾患を対象に研究開発が進められてきた。現在,主に実用化されているのは,体性幹細胞を細胞ソースとして用いるものであるが,体性幹細胞は増殖が限られるため,多くの患者の治療に必要な細胞を十分量製造することは困難である。この再生医療に必要な細胞ソースの問題を解決できると期待されているのが,京都大学の山中伸弥教授らにより開発されたiPS細胞(induced Pluripotent Stem Cell)である2)。iPS細胞は大量増幅が可能であること,さまざまな細胞に分化できる多能性を有することなどから,多くの疾病に適用でき,人々のQoL(Quality of Life)向上につながるものと期待されている。
iPS細胞を用いた最初の臨床研究は,国立研究開発法人理化学研究所による加齢黄斑変性に対する自己iPS細胞由来の網膜色素上皮シートの移植3)である。その後,iPS細胞由来の細胞を用いた臨床応用は複数実施されている。パーキンソン病治療4),角膜シートの移植5),重症心不全患者への心筋シートの移植6),血小板減少症治療7)がすでに実施されている。臨床計画が承認されたものには,脊髄損傷治療8),膝関節軟骨損傷の治療9),網膜色素変性症の治療10)と続いている。このように再生医療が広まる中で,治療用細胞の製造のほとんどは手作業で行われているため,製造コストが高額であることが依然として課題である。今後さらなる再生医療の普及を実現するためには,合理的な価格で安定的に患者に届けることのできる細胞量産化が欠かせない。日立は,この課題の解決のために自動培養技術を開発してきた。
本稿では,自動化,特に日立の自動培養技術の特長である閉鎖系装置導入のメリットについて説明するとともに,将来の自動培養技術に向けた取り組みを紹介する。
2. 閉鎖系自動培養技術
日立は2002年度から自動培養技術の開発を開始した。医療用途の細胞製造には安全性の担保が最重要であると考え,外部からの菌などの混入を防ぐ「閉鎖系」自動培養技術の開発を当初から進めてきた。閉鎖系培養は,培養に必要な培養液類を入れるボトルなどと培養容器をチューブで連結した閉鎖系流路を用い,これを培養開始前にガンマ線で滅菌して,無菌空間での細胞培養を可能にするものである。
こうしたコンセプトの下,日立は東京女子医科大学との連携によって閉鎖系自動培養技術の基盤を確立し,小スケールの自動培養装置(開発コード名ACE3)を開発し11),角膜や口腔粘膜の細胞シートの自動培養ができることを示した12)~14)。その後,理化学研究所とACE3を用いた網膜色素上皮細胞シートの自動培養に取り組み,手作業より高品質な細胞シートを作製できることを明らかにした15)。
この小型装置と並行して,大量の細胞を自動培養する装置を,東京女子医科大学,大阪大学を中心とする内閣府最先端研究開発支援プログラム「FIRST(Funding Program for World-Leading Innovative R&D on Science and Technology)プログラム」にて開発し,心筋再生に必要な細胞数(>1×109個)を自動培養できる試作機を完成させた16)。この技術をベースにして,京都大学・大日本住友製薬株式会社と共同で,iPS細胞の培養とドパミン神経前駆細胞への分化誘導の初期工程を行う自動培養装置を開発し17),これを基に大量自動培養装置(iACE2)の製品化に至った18)。
ACE3とiACE2は,培養スケールは異なるが,コンセプトはいずれも同じ閉鎖系であり,接着培養の細胞であれば,上述以外の細胞にも適用可能である(図1参照)。また,細胞を接着させず,細胞凝集塊を形成させて三次元的に増殖させる培養の自動化も実現している19)。このように,さまざまな培養スケール,細胞種に対して幅広く対応できる基盤技術として開発を進めてきた。
3. 閉鎖系自動培養技術導入の効果
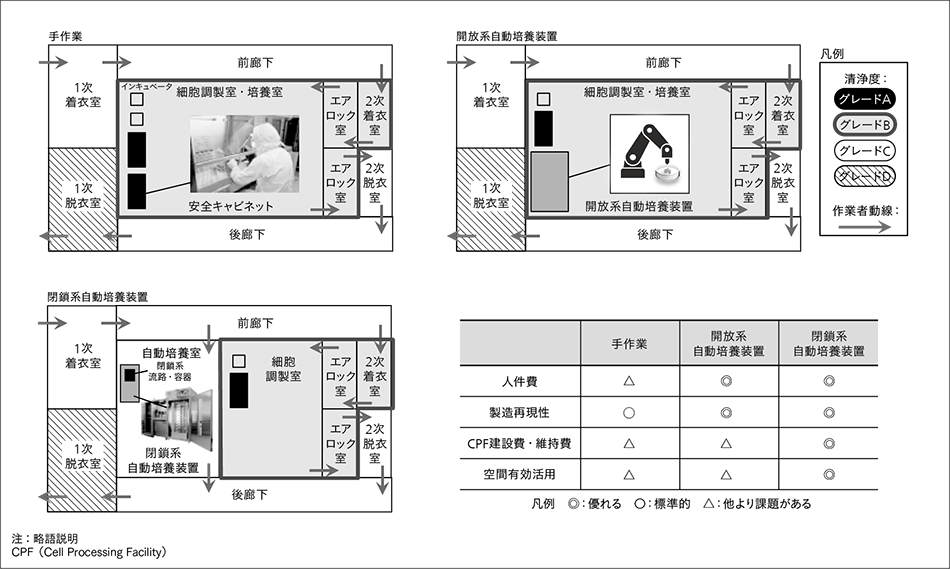
現在,再生医療に用いる治療用細胞の製造では,細胞加工施設(CPF:Cell Processing Facility)内で専門的トレーニングを受けた技術者により,手作業を中心とした培養が行われている。そのため,高い人件費,作業者の技術に依存した細胞品質のばらつき,人が介在することに起因する生物学的汚染のリスクといった課題がある。また,高度な清浄度が維持された空間で作業するため,施設維持費のコストも大きい。これらの解決には人手の作業を機械に置き換える,自動培養技術の導入が有効な方法の一つと考えられる。ここでは,特にCPF運用コストについて説明する。
CPF内は清浄度の高い順にグレードAからDまで作業空間が分けられており20),細胞を直接扱う作業は一般に最も清浄性の高い安全キャビネット内(グレードA)でなされる。この安全キャビネットは,清浄度が高度に管理された清浄度グレードBの細胞調製室内に設置される。また,作業者は生物学的汚染源とならないよう,清浄性の担保されたガウンに着替え入室する。グレードDからグレードCへの入室では1次ガウニングを行い,グレードBに入室する場合はさらに更衣を重ね着した2次ガウニングを行う。グレードBの部屋は,グレードCに比べ清浄度が高いため,部屋の換気回数が多く,清浄な環境が維持されていることを定期的に確認するモニタリング頻度も高い。
従来法では,グレードBに設置された安全キャビネット内での開放系操作と,CO2インキュベータでの培養作業を専門技術者が行う。これらの手作業を機械で置き換えるため,さまざまな自動培養技術の開発が進められている。自動培養装置は,閉鎖系自動培養装置と開放系自動培養装置に分類される(図2参照)。前者は,培養容器・培養液用ボトルなどをチューブで連結した閉鎖系流路を用いる。これらは培養終了まで開放しないことで,細胞培養空間の高い清浄性を維持する。後者は,手作業と同じ開放系培養容器を用い,多関節ロボットなどが開放系操作を行うが,それらを内部に有する筐体が外界と隔離された環境を実現することで,細胞に対する清浄性を維持する。
開放系自動培養装置は培養容器が開放系のため,自動培養の前後で装置外へ搬送する必要を考え,グレードBの空間内に設置されることが一般的である。また,多関節ロボットを内部に有するため,閉鎖系自動培養装置に比べて装置サイズは一般的には大きくなる。これに対し,日立が開発を進めている閉鎖系自動培養装置は,グレードCへの設置を想定している。これは閉鎖系流路によって,外界からの菌などの混入を回避可能なためである。
閉鎖系自動培養装置の導入は,自動化という側面から,人件費の削減効果と製造の再現性向上を実現する。また,開放系自動培養装置に比べて閉鎖系装置は一般的に小型であるため,部屋の空間を有効に活用できる。さらに開放系自動培養装置がグレードBに設置されるのに対し,相対的に清浄度の低いグレードCに設置するため,グレードBの空間をより小さくすることが可能である。加えて,装置に対し何らかの操作を行う場合,グレードCへの入室には,グレードBへの入室よりも必要な更衣枚数が少ないため,その分のコストも下げることができる。さらに,清浄性を管理するための環境モニタリングと清掃のコストも,グレードBよりグレードCの方が低い。したがって,自動培養装置導入は,手作業を自動化する効果に加え,CPFの建設・運営のコスト減という利点も有していることになる。
4. 次世代自動培養技術
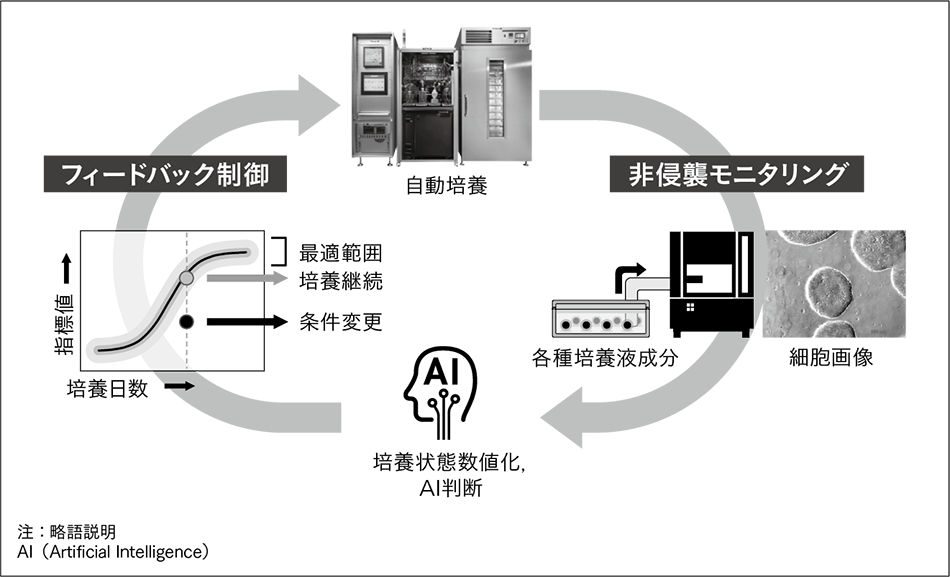
これまでの自動培養装置の開発においては,手作業の培養プロトコルを基に自動培養プロトコルを作成して自動培養を行い,手培養での細胞と同様の品質の細胞が培養できることを実証してきた。ここでは装置に手作業と同等となる閉鎖系培養をプログラムして操作するものであった。次世代の自動培養技術は,細胞状態をリアルタイムに判断し,培養に対してフィードバック制御することで,常に最適な培養を行うインテリジェントなシステムにするものである(図3参照)。これにより,再生医療用細胞の安定的,効率的供給に寄与できる。
このような自動培養システムを実現するためには,まずリアルタイムかつ非侵襲に細胞状態を評価するモニタリング技術が必要となる。現状の細胞評価手法の多くは,細胞を回収して計数したり,破壊して内部の遺伝子発現を解析したりするなど侵襲的であり,かつ時間を要する評価法である。そのため,自動培養装置に搭載することを前提に,リアルタイムかつ非侵襲な細胞モニタリング技術の開発を開始した21)。自動培養中にリアルタイムで細胞状態が把握できるようになることで培養の最適化を可能とし,さらに万が一の逸脱時には培養継続の可否の判断を行い,ロスコストの最小化にもつながる。
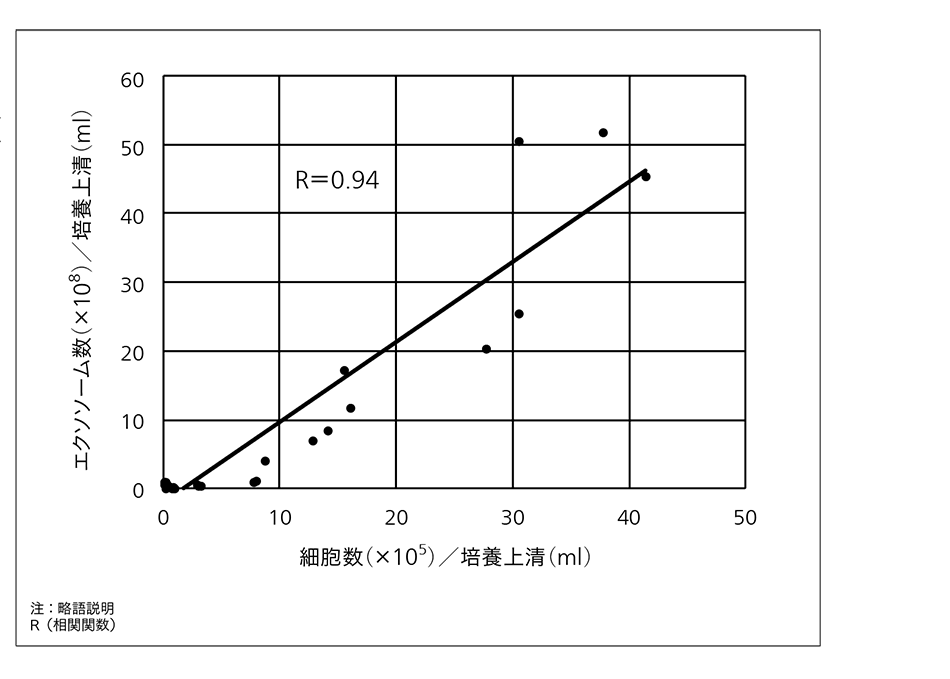
現在,細胞画像と培養上清(培養液)中の成分に着目し,これらのモニタリング技術を開発している。特に,新たな試みとして培養上清中に細胞から放出された小胞(エクソソーム)の計測を行っている。培養上清は培地交換の際に非侵襲に回収することが可能であり,モニタリングに適する。エクソソームは細胞内の情報を多く有し,がん診断のマーカーとしても注目されているが,ここでは培養中の細胞状態のモニタリングマーカーとしての適用を検討している。iPS細胞の培養上清に含まれるエクソソーム数をさまざまな段階で計測し,その時の細胞数と比較したところ,高い相関関係があることが分かった(図4参照)。したがって,培養上清中のエクソソーム数から細胞増殖率を評価可能だと考えられる。ここでは数に着目したが,エクソソームのその他のパラメータや内部のmiRNA(microRNA)の分析により多くの情報が得られると期待されており,有力なモニタリング対象として,その計測技術の開発を進めていきたい。
こうしたモニタリング技術によって,人手と人の判断で行ってきた細胞培養を数値データで管理できるようになり,さらにそれらを基に培養へフィードバック制御を行うことで,人手を介さずにリアルタイムで培養の最適化を行うことができる。このように細胞製造をデジタル化することで,日立が推進するLumadaのプラットフォームを活用することができ,細胞製造のさらなる効率化をはじめ,新たな価値の創出が期待できる。
5. おわりに
現状は手作業でコストが高い細胞製造を自動化することで,合理的コストで細胞を製造できるようになる。それとともに他家iPS細胞(他人のiPS細胞)を利用した再生医療の実用化で,再生医療の有効性や根治が可能となるメリットを多くの人々が享受できるようになる。一方で,免疫拒絶のおそれが極めて少ないことから,自家再生医療(自己細胞の移植)もさらにQoLの高い医療として期待が高まると考えられる。自家移植の場合,患者ごとに細胞のコンディションが異なるため,ここでもインテリジェント自動培養システムは威力を発揮すると期待される。また自家移植の場合,製造する細胞は個人にひも付けられたものであり,採取から移植までのトレーサビリティも重要となってくる。
再生医療にはこれまでの医薬品にはない,さまざまなプロセスが必要である。これに対し日立では,多数のグループ会社がOne Hitachiとなり,再生医療のトータルソリューションを提供し,この革新的な医療の普及に貢献できる。海外の第一歩として台湾から開始し22),グローバル展開を加速していく予定である。世界中の人々が再生医療を享受できる社会の実現に貢献していきたい。
謝辞
本稿で紹介した内容の一部は,国立研究開発法人新エネルギー・産業技術総合開発機構(NEDO:New Energy and Industrial Technology Development Organization)の基盤技術研究促進事業「組織再生移植に向けたナノバイオインターフェイス技術の開発」,文部科学省先端融合領域イノベーション創出拠点形成プログラム「再生医療本格化のための最先端技術融合拠点」,内閣府最先端研究開発支援プログラム(FIRSTプログラム)「再生医療産業化に向けたシステムインテグレーション-臓器ファクトリーの創生-」,国立研究開発法人日本医療研究開発機構(AMED:Japan Agency for Medical Research and Development)課題番号JP20be0404010,公益財団法人神戸医療産業都市推進機構「神戸医療産業都市研究開発助成金」の若手研究者支援枠において実施した。本研究開発にあたり,指導・協力いただいた,東京女子医科大学,大阪大学,京都大学iPS細胞研究所,理化学研究所,大日本住友製薬株式会社の関係各位に感謝申し上げる次第である。
参考文献など
- 1)
- R.Langer et al.: Tissue engineering, Science, Vol.260, 5110.pp.920-926(1993.5)
- 2)
- K.Takahashi et al.: Induction of pluripotent stem cells from adult human fibroblasts by defined factors, Cell, Vol.131,5, pp.861-872(2007.11)
- 3)
- 理化学研究所 多細胞システム形成研究センター:iPS臨床研究:一章例目の移植を実施 (2014.9)
M.Mandai et al.: Autologous Induced Stem-Cell-Derived Retinal Cells for Macular Degeneration., New England Journal of Medicine, Vol.376, pp.1038-1046(2017.3) - 4)
- 京都大学 iPS細胞研究所CiRA:パーキンソン病霊長類モデルにおけるヒトiPS細胞由来ドパミン神経前駆細胞の移植の有効性と安全性の確認(2017.8)
- 5)
- 大阪大学大学院医学系研究科・医学部:世界初,iPS細胞から作製した角膜上皮細胞シートの第1例目の移植を実施(2019.8)
- 6)
- 大阪大学大学院医学系研究科・医学部:iPS細胞から作製した心筋細胞シートの医師主導治験の実施~重症心筋症の治療に向けて~(2020.1)
- 7)
- 京都大学 iPS細胞研究所CiRA:「血小板減少症に対するiPS細胞由来血小板の自己輸血に関する臨床研究」の実施について (2020.3)
- 8)
- 慶應義塾大学医学部:「亜急性期脊髄損傷に対する iPS 細胞由来神経前駆細胞を用いた再生医療」の臨床研究について(研究開始了承)(2019.2)
- 9)
- 京都大学 iPS細胞研究所CiRA:同種iPS細胞由来軟骨移植による関節軟骨損傷の再生について(2020.1)
- 10)
- 地方独立行政法人神戸市民病院機構神戸市立神戸アイセンター病院:「網膜色素変性に対する同種(ヒト)iPS細胞由来網膜シート移植に関する臨床研究」について(2020.6)
- 11)
- 小林豊茂,外:自動培養装置が拓く再生医療の将来,医療機器学,Vol.81, No.6, pp.446~451(2012.2).
- 12)
- R. Nakajima et al.: A novel closed cell culture device for fabrication of corneal epithelial cell sheets., Journal of tissue engineering and regenerative medicine, Vol.9, No.11, pp.1259-1267(2012.12)
- 13)
- 小林豊茂,外:第18章 角膜および食道再生用小型自動培養装置,再生医療の細胞培養技術と産業展開,シーエムシー出版,東京,pp.177~186(2014.6)
- 14)
- E. Matsumoto et al.: Fabricating retinal pigment epithelial cell sheets derived from human induced pluripotent stem cells in an automated closed culture system for regenerative medicine, PLOS ONE, Vol.14, No,3(2019.3)
- 15)
- A. Nishimura et al.: Fabrication of tissue-engineered cell sheets by automated cell culture equipment, Journal of Tissue Engineering and Regenerative Medicine, Vol.13, No.12, pp.2246-2255,(2019.11)
- 16)
- 小林豊茂,外:精密工学の再生医療への貢献,精密工学,Vol.80, No.3, pp.252~258,(2014.3)
- 17)
- 加藤美登里,iPS細胞大量自動培養装置の開発,Medical Science Digest, Vol.44, No.8, pp.35~37(2018.7)
- 18)
- 日立ニュースリリース,大日本住友製薬からヒトiPS細胞を用いた再生医療向け大量自動培養装置を受注(2017.4)
- 19)
- 日立ニュースリリース,再生医療の普及に向け,細胞の3次元培養法の自動化技術を開発(2019.11)
- 20)
- 厚生労働省,無菌医薬品製造区域の環境モニタリング法,第一七改正日本薬局方針,pp.2424~2429(2016.3)
- 21)
- 国立研究開発法人日本医療研究開発機構,採択情報 平成31年(令和元年)度 「再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生医療シーズ開発加速支援)」の採択課題について(2019.8)
- 22)
- 日立ニュースリリース,台湾日立アジアパシフィック社がMetaTech(AP)Inc.と再生医療分野の合弁会社設立に合意(2020.4)