個別化がん免疫治療をめざす免疫細胞のデジタル計測技術
ハイライト
近年,さまざまながん治療法が開発され,医療現場で応用されている。その中の一つとして,免疫治療の一種として用いられる免疫チェックポイント阻害剤は,進行がんに対するこれまでにない長期治療効果を実現した。しかし,その奏効率は十分でなく,多くの進行がん患者は恩恵を受けられていない。治療薬の適用範囲拡大と奏効率の向上のため,複数の治療法を組み合わせた併用療法とその効果を予測する検査法の開発が活発化している。
日立は検査技術の候補として,がん細胞に対する免疫応答を高精度に計測する単一細胞解析技術に取り組んでいる。これは従来の細胞染色によるアナログ計測技術に対し,細胞内の遺伝子にDNAバーコードをデジタルタグとして導入し,次世代DNAシーケンシングによってそれぞれの遺伝子を分子カウントする高精度計測技術である。本稿では,免疫治療薬開発のためのバイオマーカ開発動向と,単一細胞解析を活用した個別化医療実現のための取り組みを紹介する。

1. はじめに
がん細胞によって抑制された免疫機能を回復させる免疫チェックポイント阻害剤(ICI:Immune Checkpoint Inhibitor)は,一部の進行がん患者に対し,根治とも言える長期治療効果をもたらすが,潜在的な患者の多くはその恩恵を得られていない1)。奏効率の向上と適応がん種の拡大に向け,その他の治療法や治療薬と組み合わせた併用療法の治験が,2019年9月時点で世界で2,949件進行中である2)。また,奏効率の向上をもたらす適切な治療薬の選択のため,正確に薬効を予測するバイオマーカの開発も活発である1)。一方,次世代DNAシーケンサー(NGS:Next Generation Sequencer)の実用化による配列解析コストの低減によって,米国を中心にゲノム情報を活用した医療が開始され,日本でも2019年6月からがんゲノム医療が保険適用された3)。がんの進行は免疫系との複雑な相互作用の結果であるため,がんの病態解明とそれに基づく適切な治療には,従来から実施されているがん細胞の解析のみならず,免疫細胞の解析の重要性が認識され始めている。特に最近では,免疫細胞を直接計測する薬効予測バイオマーカが期待されている1)。
本稿では,ICIを含む免疫治療薬の開発のためのバイオマーカ開発動向と単一細胞解析を用いた個別化医療実現のための取り組みを紹介する。
2. がん免疫治療法とバイオマーカの開発動向
体内には,多様な免疫細胞が全身を循環しながら数十のパスウェイ(細胞間シグナル伝達)で連携するがん免疫サイクルが存在し,がん細胞を認識・排除している(図1参照)4)。一方,がんが進行する際は,がん免疫サイクルが何らかの滞りを伴っている。免疫治療とは,このサイクルを循環させ,個体が本来有する免疫機能によりがん細胞を死滅させる治療法である。上述したICIは,がん細胞によって抑えられていた免疫機能を再び活性化させる治療薬である1)。例えば,ICIの一種である抗PD-1抗体薬あるいは抗PD-L1抗体薬は,図1中の(7)のプロセスで,免疫細胞(T細胞)から逃れるためにがん細胞が出していたシグナルを阻害する。これにより本来のT細胞の攻撃力が回復する。
図1|がん免疫サイクルのイメージ図  多くのがん細胞は(1)~(7)のがん免疫サイクルのプロセスによって組織から適切に除去される。がん免疫サイクルのいずれか一つ以上のプロセスをがん細胞が阻害または逃避するとき,がん組織は成長する。がん免疫治療薬は免疫サイクルを回復する機能を持つ。
多くのがん細胞は(1)~(7)のがん免疫サイクルのプロセスによって組織から適切に除去される。がん免疫サイクルのいずれか一つ以上のプロセスをがん細胞が阻害または逃避するとき,がん組織は成長する。がん免疫治療薬は免疫サイクルを回復する機能を持つ。
2.1 ICIと多数の開発中の併用療法
図2|免疫チェックポイント阻害剤の進行がんに対する長期治療効果の模式図 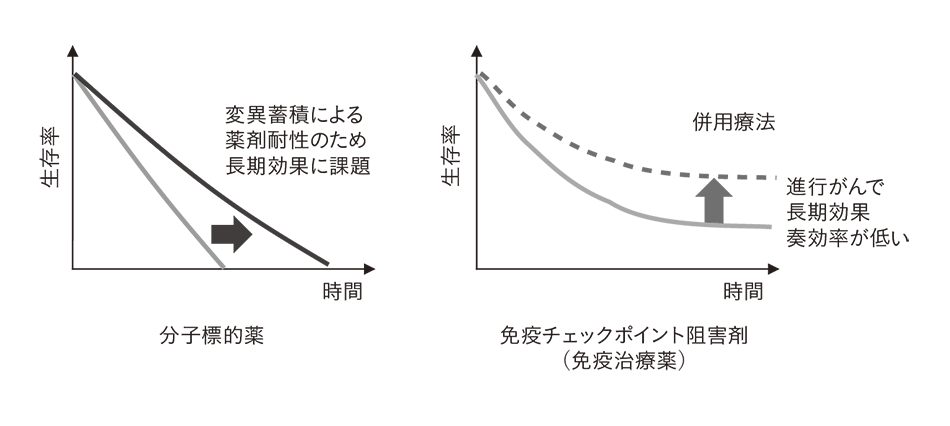 従来の分子標的薬による化学療法では,変異の蓄積による薬剤耐性変異の出現で薬効が失われるために,長期的な治療効果が得られない。がん免疫治療薬の場合は,生体が持っている免疫機能を回復させるため,薬効が得られれば長期的な効果が得られ,治療法の併用による奏効率の向上も期待できる。
従来の分子標的薬による化学療法では,変異の蓄積による薬剤耐性変異の出現で薬効が失われるために,長期的な治療効果が得られない。がん免疫治療薬の場合は,生体が持っている免疫機能を回復させるため,薬効が得られれば長期的な効果が得られ,治療法の併用による奏効率の向上も期待できる。
図2はICIの進行がんに対する長期治療効果の模式図である。ICIは,従来の分子標的薬による化学療法で課題であった薬剤耐性を受けにくいことから,一部の患者に対して,著しい長期治療効果が確認されている1),5)。ただし,既存のバイオマーカを用いても治療効果を示す患者の割合(奏効率)が40~50%以下と低く6),免疫阻害要因を同定して最適な併用療法を提案することのできるバイオマーカの開発が重要である。
2.2 がん免疫バイオマーカの開発動向
投薬前に薬剤の効果や副作用を判定する検査をコンパニオン診断と呼ぶ。2020年9月時点で米国にて承認されている,ICIのコンパニオン診断は以下の4種類である1),2)。
- PD-L1法
免疫組織染色でがん組織中のPD-L1を定量する方法 - TMB(Tumor Mutational Burden)法
NGSによるゲノム解析で変異の頻度を定量する方法 - MSI(Microsatellite Instability)法
DNA複製の正確性を評価する方法として2種類のマイクロサテライトと呼ばれる遺伝子多型を電気泳動解析する方法 - dMMR(Deficient Mismatch Repair)法
DNAミスマッチ修復遺伝子の欠損状態を定量評価する方法
このうち多く使われる最初の2種類の検査に関して,多数の治験のメタ解析における検査精度の統計解析の結果,精度が十分でないことが示されている6)。例えば,陽性の場合に正しく治療効果を判定する確率(PPV: Positive Predictive Value)がPD-L1法とTMB法でそれぞれ,0.40(0.36-0.45)※)と0.54(0.47-0.60)※)で,約半数の患者は検査が陽性でも薬効が得られない。また,MSI法とdMMR法についても,大腸がんの検査陽性患者に対するPPVは0.50および0.53であり,十分ではない7),8)。これらはすべてがん細胞を対象とした検査である。一方で,患者の免疫状態を正しく把握することを目的としたさまざまな検査法が国内外で開発されているが,高精度の検査法としては確立していない1)。特にがん組織に浸潤した免疫細胞の活性を調べる検査として,識別精度の高いバイオマーカの発見が期待されている。また,識別精度を高めるために,複数のバイオマーカや解析法を統合する検査も提案されている1)。複数検査を統合するときには,検査間の独立性が重要である。PD-L1法とTMB法には独立性があるため,その組み合わせが試みられたが,十分な識別精度には至っていない6)。そこで,こうした既存のバイオマーカに,免疫応答に関連する複数のバイオマーカを統合して識別精度を向上させる臨床研究が注目されている。フローサイトメトリーによる細胞の分類に加えて,個々の免疫細胞を機能別に分類して解析する単一細胞解析の有効性が示されている9)。
- ※)
- 括弧内は95%信頼区間を示す。
3. 創薬・個別化医療をめざした単一細胞解析プラットフォーム
NGSの実用化を契機に,精密医療(Precision Medicine)と呼ばれる患者ゲノムのDNA配列情報を活用した医療が成果を上げている3)。一方で,ICIによる治療選択肢の拡大と多様な併用療法の開発は精密医療に新たな機会を与えている。すなわち,がん細胞の遺伝子変異に関して蓄積された包括的な臨床データは,ICIのコンパニオン診断としてTMB法に活用されている1)。この手法を多種多様な免疫細胞にも適用することにより,がん免疫応答に関するエビデンスを蓄積し,より精密なICIコンパニオン診断法の開発に活用できると考えられる。がん免疫サイクルの滞りは患者ごとに異なるため,病態の進行を継続的に検査することで,個々人の免疫状態に応じた確度の高い治療法の選択(個別化医療)に結び付けることが期待される。
日立は,2012年からNGSでデータ取得することを前提とした単一細胞遺伝子解析デバイスVFACs(Vertical Flow Array Chips)を開発し,前述した医療の状況を踏まえた実装可能な高精度免疫細胞検査法の確立をめざしている10)。
3.1 単一細胞遺伝子解析の特徴と期待
免疫細胞は多種類の細胞が連携して機能するため,免疫研究では,細胞ごとに解析できるフローサイトメトリーが標準的に利用されてきた。近年のNGSの低コスト化と普及により,フローサイトメトリーの課題であった定量性の課題を解決できる可能性がある1),11)。すなわち,DNAバーコード法による遺伝子発現定量の高精度化が期待される12),13)。
3.2 DNAバーコード法
DNAバーコードを利用したNGS解析は,多数の検体を一括シーケンシングする方法として一般的である。DNAバーコードは,単一細胞解析において二つの重要な役割を持つ。一つめは,多数の細胞が混ざった配列データから細胞を識別する役割である。二つめはNGSで個々の細胞中に発現する遺伝子(mRNA:messenger Ribonucleic Acid)を分子レベルで識別する役割である。それゆえ,DNAバーコードを利用した単一細胞解析では,細胞数,分子数の絶対値のカウントが可能となる。一方で,DNAバーコードを利用しない従来の解析の場合は,投入サンプルの一部しかシーケンス解析されないため,得られる遺伝子発現量は相対値である。
3.3 単一細胞解析VFACsの構造と特徴
図3|VFACsの模式図 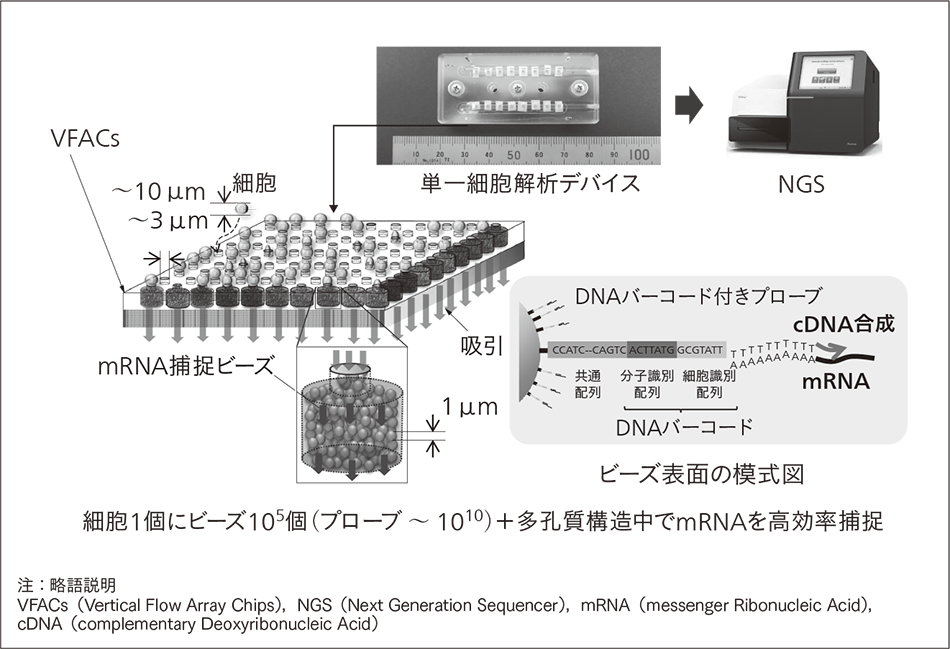 多数の細胞に同時にDNAバーコードを挿入し,一括してNGS用サンプルを調整することでコストを低減するとともに,一つの細胞に対して多数のDNAバーコード付きプローブが固定されたビーズを対応させることで,高効率にmRNAにバーコードを挿入できる。
多数の細胞に同時にDNAバーコードを挿入し,一括してNGS用サンプルを調整することでコストを低減するとともに,一つの細胞に対して多数のDNAバーコード付きプローブが固定されたビーズを対応させることで,高効率にmRNAにバーコードを挿入できる。
日立では図3に示すような,単一細胞解析デバイスVFACsを開発してきた10)。個々の細胞由来のmRNAへ効率よくDNAバーコードを導入することで,高感度かつ高精度な遺伝子定量解析を可能にするとともに,多数の細胞をVFACsごとに一括して処理することで試薬コストが抑制できる。図3のVFACsの細胞捕捉孔は,一つにつき1010分子のmRNA捕捉用DNAプローブ(DNAバーコード含む)が固定されたビーズが充填されているため,個々の細胞から溶出されたmRNA(105-6)分子を高効率で捕捉できる。捕捉後の一連の工程を経て得られた配列データ中には,細胞中のmRNA分子が他の方法より高効率に回収可能である10)。
3.4 創薬・個別化医療をめざした単一細胞解析プラットフォームの提案
4. VFACsのがん免疫メカニズム解析への適用
東京大学附属病院免疫細胞治療学講座(垣見研究室)との共同研究を行い,VFACsによる単一細胞解析を実施し,マウスの胃がんにおける微小環境と免疫細胞の相互作用の解析,および治療薬における抗腫瘍効果の評価を試みた14)。
4.1 目的
マウスの胃がん組織に浸潤したT細胞における単一細胞解析を実施し,44種の免疫関連遺伝子の発現量を計測後,がん免疫応答のキーシグナルを抽出できるか評価した。
4.2 方法
2種類の胃がん細胞株(YTN2,およびYTN16)を正常マウス(C57BL/6N)へ移植し,2種類の胃がんモデルとしてYTN2マウスおよびYTN16マウスを作製した。YTN2マウスは悪性度が低く,免疫機能によってがん組織は約20日程度で消失するが,YTN16マウスは悪性度が高く,がん組織サイズは時間とともに増大する。がん組織浸潤免疫細胞(がん細胞株を移植後7日目)からT細胞をセルソータで選別してVFACs上に分注し,調製後試料をNGS解析した。
4.3 結果
解析の結果,YTN2マウスおよびYTN16マウス合わせて1,098個のT細胞から,44種の免疫関連遺伝子に関する発現プロファイルが得られた。
図5(a)に教師なしクラスタリング(Louvain法)によって色分けされた二次元射影散布図を,図5(b)にヒートマップを示す。抽出されたクラスタ6はYTN16マウス由来の細胞のみから構成されており,緑の矢印で示すIL-17遺伝子が高発現していることに着目した。これによりYTN16マウスにおけるがん免疫抑制に,IL-17遺伝子が関連することが示唆された。
抽出されたIL-17遺伝子の機能を確かめるために,YTN16マウスに何も投与しない条件をコントロールとし,抗IL-17抗体を単独投与した条件,ICIの一つである抗PD-1抗体を単独投与した条件,および両方を併用投与した条件でがんのサイズ変化を比較評価した[図5(c)参照]。その結果,抗PD-1抗体との併用投与では,10匹中8匹でがん組織が速やかに消失する高い抗腫瘍効果が認められた。本結果より,VFACsを用いた単一細胞解析で,がん免疫に関連する遺伝子変化シグナルを抽出できることが示唆できた。また抽出シグナルを利用した免疫治療による抗腫瘍効果は高いことが確認できた。なお,IL-17に関する発現の特徴は従来のRNA-seq(RNA-sequencing)解析では検出できず,単一細胞解析の有用性が確認できた14)。
図5|VFACsのマウスがん組織中T細胞の単一細胞解析結果と抽出されたシグナルのがん抑制効果の検証 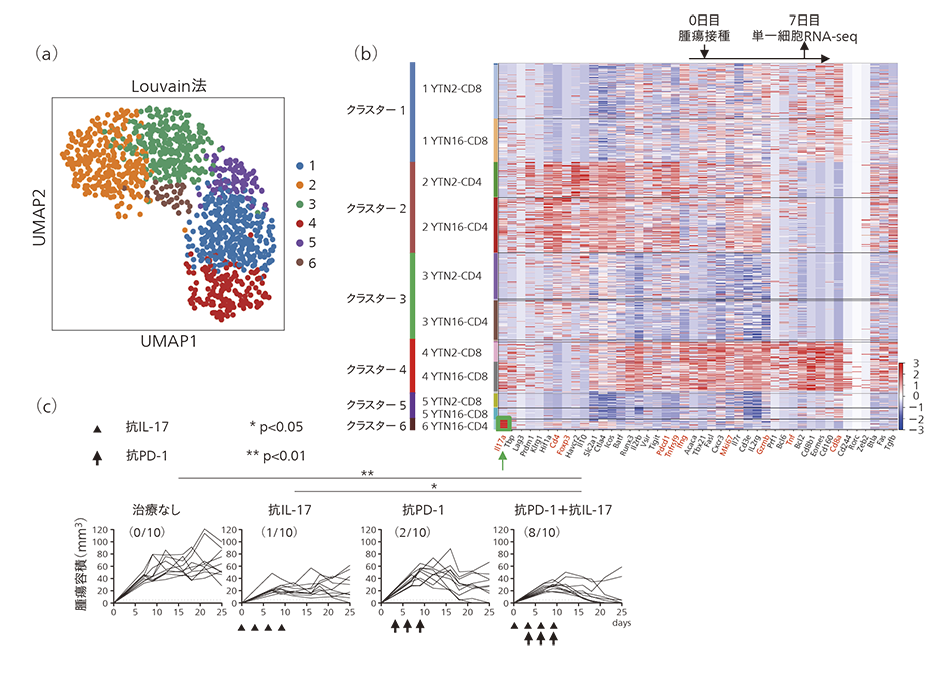 (a)はVFACsによる単一細胞結果を教師なしクラスタリング(Louvain法)にて,クラスタリング結果を次元削減法の一つUMAP法を用いて二次元に射影した結果を示す。(b)は,(a)と同じ結果のヒートマップ表示である。(c)は,抽出されたIL-17のシグナルを阻害したときのがん免疫活性化効果を示す。
(a)はVFACsによる単一細胞結果を教師なしクラスタリング(Louvain法)にて,クラスタリング結果を次元削減法の一つUMAP法を用いて二次元に射影した結果を示す。(b)は,(a)と同じ結果のヒートマップ表示である。(c)は,抽出されたIL-17のシグナルを阻害したときのがん免疫活性化効果を示す。
5. おわりに
近年,注目されているがん免疫治療に関して,併用療法を含む最適な治療スキームの開発や治験が急速に進展している。一方,最適な治療法を選択するバイオマーカの研究開発も活発化しているが,成果は道半ばの状況である。日立は今後,デジタル技術とがん免疫検査の融合によって低コスト化を図り,がん治療に貢献するとともに,感染症をはじめとした免疫応答が関連する多様な疾患にも利用されるよう,尽力していく考えである。
謝辞
本稿で述べた単一細胞解析デバイスVFACsの評価においては,東京大学医学部附属病院垣見和宏教授をはじめとする多くの先生方にご協力いただいた。深く感謝の意を表する次第である。
参考文献など
- 1)
- J. J. Havel et al.: The evolving landscape of biomarkers for checkpoint inhibitor immunotherapy, Nature Reviews Cancer, Vol.19, pp. 133-150(2019.3)
- 2)
- S. Upadhaya et al.: Combinations Take centre stage in PD1/PDL1 inhibitor clinical trials, Nature Reviews Drug Discovery, BIOBUSINESS BRIEFS(2020.11)
- 3)
- H. Mano: Cancer genomic medicine in Japan, Proceedings of the Japan Academy, Series B, Vol.96, No.7, pp. 316-321(2020.6)
- 4)
- D. S. Chen: Oncology meets immunology: the cancer-immunity cycle, Immunity, Vol.39, pp. 1-10(2013.7)
- 5)
- P. Sharma et al.: Immune Checkpoint Targeting in Cancer Therapy: Toward Combination Strategies with Curative Potential, Cell, Vol.161, pp. 205-214(2015.4)
- 6)
- A. Mariam et al.: Large-Scale Meta-Analysis of Potential Biomarkers 1 for Treatment Response to Anti-PD-1/PD-L1 Immune Checkpoint Inhibitors, medRxiv(2020.11)
- 7)
- F. Battaglin et al.: Microsatellite instability in colorectal cancer: overview of its clinical significance and novel perspectives, Clinical advances in hematology & oncology, Vol.16, pp. 735-745(2018.11)
- 8)
- D. T. Le et al.: Mismatch-repair deficiency predicts response of solid tumors to PD-1 blockade, Science, Vol.357, 6349, pp. 409-413(2017.7)
- 9)
- M. Sade-Feldman et al.: Defining T Cell States Associated with Response to Checkpoint Immunotherapy in Melanoma, Cell, Vol.175, pp. 998-1013(2018.11)
- 10)
- M. Shirai et al.: Vertical flow array chips reliably identify cell types from single-cell mRNA sequencing experiments, Scientific Reports, Vol.6, 36014(2016.11)
- 11)
- S. Yamamoto et al.: Quantitative application of flow cytometry for the analysis of circulating human T cells: A preclinical pharmacokinetic study, Drug metabolism and Pharmacokinetics, Vol.35, 2, pp. 207-213(2019.12)
- 12)
- T. Kivioja et al.: Counting absolute numbers of molecules using unique molecular identifiers, Nat Methods, Vol.9, pp. 72-74(2011.11)
- 13)
- S. Islam et al.: Quantitative single-cell RNA-seq with unique molecular identifiers, Nat Methods, Vol.11, pp. 163-166(2014.2)
- 14)
- K. Nagaoka et al.: Deep immunophenotyping at the single-cell level identifies a combination of anti-IL-17 and checkpoint blockade as an effective treatment in a preclinical model of data-guided personalized immunotherapy, J. Immunother. Cancer, Vol.8, e001358(2020.8)








