ヘルスケア分野における卓上型走査電子顕微鏡の応用生体組織/細菌検査における光の分解能を超えた微細構造解析
ハイライト
卓上型の走査電子顕微鏡(卓上SEM)は,物質表面の微細構造を観察する装置として,材料やバイオテクノロジーをはじめとしたさまざまな産業分野において利用されている。観察を行うにあたって,金属蒸着など電子顕微鏡特有の前処理が不要という簡便性のため,これまで光学式の顕微鏡が主に利用されてきたバイオメディカル分野でも幅広く使用されている。
本稿では,臨床も含めたヘルスケア分野での活用に向けた,卓上SEMを用いた腎生検法の検討と,細菌の薬剤感受性試験の事例について紹介する。

1. はじめに
生体組織形態を観察する病理学には100年以上の歴史があり,その形態観察においては光学式の顕微鏡が重要な役割を果たしてきた。
光を透過させて顕微鏡で観察する程度の試料サイズの場合,光の透過量が多くなるため,標本は透明体に近い。そのため,特有の色素を用いて染色し,色の違いを明確化して観察する。この染色技術の発展が長年病理学を支えている。通常の可視光では最も目の感度が高い緑色の波長が500 nm前後であるため,一般的な光学式の顕微鏡では数百ナノメートル程度が最小観察サイズとなり,それ以上小さいものを観察する場合は電子顕微鏡を用いる必要がある。
SEM(Scanning Electron Microscope:走査電子顕微鏡)やTEM(Transmission Electron Microscope:透過電子顕微鏡)は,物質の微細構造を観察する装置として,さまざまな産業分野において幅広く利用されている。観察対象に電子線を照射して物質から放出される電子の数に基づいて画像を形成する仕組みのため,色がないグレースケール画像での観察となるが,電子顕微鏡の分解能は10~1 nm,もしくはそれ以下にまで及ぶため,より細かい形態を観察したい場合に電子顕微鏡が多く利用されている。
電子顕微鏡はより小さい領域の観察に適しているものの,装置自体が非常に大型であり,観察にあたっては金属蒸着や金属染色といった前処理が必須である。そのため,病理などの実臨床現場では光学顕微鏡と比較すると電子顕微鏡の利用は少ない。
本稿では,通常,光学顕微鏡が主に用いられている,試料の観察を目的として開発した卓上SEMの特徴と,実臨床などのヘルスケア分野における電子顕微鏡の活用に向けた,生体組織観察による腎生検への応用,細菌の薬剤感受性試験への応用可能性を追求した研究事例を紹介する。
2. 卓上型の低真空SEM
マイナスの電荷を帯びた電子線を試料に照射すると,観察試料が帯電する。帯電した試料表面に次々に電子線が照射されると,電子線の軌道は変化し,検出信号も検出器に届かなくなる。このような電子顕微鏡特有の物理現象によって,電子顕微鏡の対象サンプルは試料に金属蒸着を行うことが一般的であった。しかし,金属蒸着は手間がかかるうえに,電子顕微鏡とは別に金属蒸着装置が必要となる。
そこで,株式会社日立ハイテクは,金属蒸着など電子顕微鏡に特有の前処理が不要で卓上に設置可能なSEMを開発した(図1参照)。本卓上SEMでは,真空排気系の制御により試料室内部に微小な空気が入る構造のため,試料空間上の気圧は数パスカルから数十パスカルに維持される。この気圧における気体が試料表面の帯電を軽減させることができるため1),前述の金属蒸着などが不要となる。手軽かつ小型であることから,従来,電子顕微鏡が使われなかった部品製造時の品質検査や,バイオメディカル分野への適応も増えつつある。
3. 生体組織観察による腎生検への応用
図2|腎糸球体の膜性腎症のTEM像と低真空SEM像の比較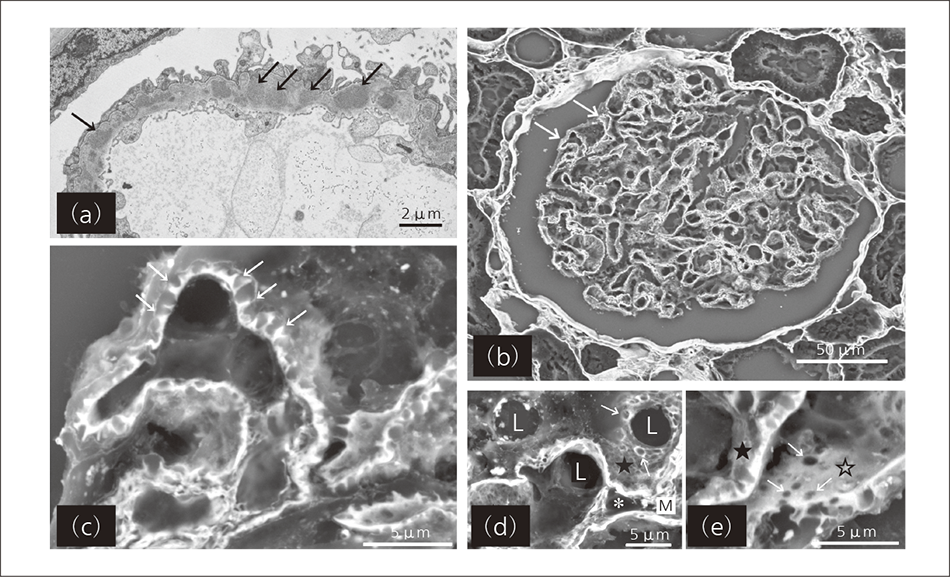 (a)はTEM(Transmission Electron Microscope)で撮影した基底膜内の免役物質沈着(黒矢印部)によるスパイク形成像を示す。(b)~(e)は,PAM(Periodic Acid Methenamine Silver)染色のSEM(Scanning Electron Microscope)像を示す。(b)は低倍率,(c)は高倍率の基底膜のスパイク構造(白矢印)を示し,(d)上皮側(★部)の基底膜表面にはクレーター状構造(白矢印部),(e)内皮側(☆部)の基底膜表面は平坦で大小の穴(白矢印部)が見られる。図中のLは毛細管腔を,*はメサンギウム細胞をそれぞれ示す。
(a)はTEM(Transmission Electron Microscope)で撮影した基底膜内の免役物質沈着(黒矢印部)によるスパイク形成像を示す。(b)~(e)は,PAM(Periodic Acid Methenamine Silver)染色のSEM(Scanning Electron Microscope)像を示す。(b)は低倍率,(c)は高倍率の基底膜のスパイク構造(白矢印)を示し,(d)上皮側(★部)の基底膜表面にはクレーター状構造(白矢印部),(e)内皮側(☆部)の基底膜表面は平坦で大小の穴(白矢印部)が見られる。図中のLは毛細管腔を,*はメサンギウム細胞をそれぞれ示す。
腎生検法は,細い針で腎臓の組織の一部を採り,光学顕微鏡で観察する。後に抗体の機能を持つ免疫グロブリンや補体などの沈着の有無とパターンから免疫反応の情報を得る蛍光抗体法,電子顕微鏡解析が加わり,現在ではこれらの三つの情報を総合して,疾患の鑑別や予後の判定,治療方針の決定が行われている。
電子顕微鏡を用いた観察のほとんどはTEMで行われるが,試料の作成と画像の解析には高度な知識と技術を要し,診断が確定するまで数週間かかることもある。また,腎臓疾患においては,腎臓の中で一様に病変が起こっているとは限らないため,病変部分を見つけて観察しないと異常の有無を判別できない。そのため,TEM画像中の小さな領域内の組織に異常がなければ,病変の有無に関わらず,診断上は異常がないと判定されてしまう。
これに対し,簡便で迅速な検査をめざして,卓上型の低真空SEMを用いた病理組織解析法が開発された2),3)。低真空SEMでは,金属蒸着など特殊な前処理をすることなく高倍率で,かつ腎生検の組織全体を隅々まで光学顕微鏡のように俯瞰的に,スライドガラスに貼り付けた光学顕微鏡用の組織切片を観察することができる。つまり,低真空SEMは広範囲を観察でき,ごく一部の病変を見落としにくいという点で非常に有用である。
腎糸球体疾患においては,臨床的に蛋白尿の目立つネフローゼ症候群を呈するものが多いが,その原因疾患の一つとして膜性腎症(Membranous Nephropathy)がある。この疾患は,腎糸球体基底膜に沿って広範囲に免疫複合物が沈着し,基底膜の構造変化を来して糸球体からの蛋白漏出が高進し,著明な蛋白尿をもたらす。診断確定のためには,蛍光抗体法により主として免疫グロブリンのIgG,補体成分であるC3の糸球体基底膜への沈着を確認し,TEM像において基底膜の上皮下領域への沈着物およびこれを囲む基底膜成分の棘上突起(スパイク像)形成を認めることが原則とされている[図2(a)参照]。
膜性腎症の典型的な例である光顕標本では,PAM(Periodic Acid Methenamine Silver:過ヨウ素酸メセナミン銀)染色標本において基底膜の外側面(上皮側)に黒褐色に染まる多数の棘状突起が認められ,これをスパイクと称している4)。病期の進行した光顕PAM染色標本を低真空SEMで観察すると,銀陰性の上皮細胞や基底膜に沈着した免疫複合物は不明瞭化ないし透明化し,銀陽性である基底膜の変化の詳細が明確に示される[同図(b)~(e)参照]。低真空SEMによる三次元像を見ると,TEM像による二次元像とは異なり,基底膜のスパイク像とされていた所見は,実は沈着した免疫複合物に対し反応性に伸びてきた基底膜成分が,上皮側の基底膜表面に取り囲まれたクレーター状構造であることが見て取れる[同図(e)参照]。
このように,腎生検組織光顕標本の低真空SEMによる三次元的な形態把握により,これまで把握し得なかった組織変化の詳細の認識が可能となる。
4. 細菌観察による薬剤感受性試験への応用
図3|大腸菌におけるIPM薬剤感受性菌と耐性菌のSEM像と長さ計測値 (a)に示すとおり,薬剤(IPM:イミペネム)を加えた感受性菌では60分後に形態変化が起こるのに対して,耐性菌では形態変化は観察されない。また(b)は,感受性菌と耐性菌それぞれの細菌幅と細菌数の関係を示す。
(a)に示すとおり,薬剤(IPM:イミペネム)を加えた感受性菌では60分後に形態変化が起こるのに対して,耐性菌では形態変化は観察されない。また(b)は,感受性菌と耐性菌それぞれの細菌幅と細菌数の関係を示す。
AMR(Antimicrobial Resistance:微生物の薬剤耐性)は,今後,数十年のうちに人類が直面する最大の健康問題の一つと考えられている5)。このため,AMRを持つ菌の発生と拡大への対策,そして検査法と治療薬の開発は,人類共通の課題である。
AMRを持つ菌が世界的に広がる中,臨床では,重篤な血流感染などの起炎菌が,候補の抗菌薬に感受性を有するかどうかを検査し,菌に対して効果がある薬を選択するAST(Antimicrobial Susceptibility Test:薬剤感受性試験)を行っている6)。
現在,ASTの標準法とされる微量液体希釈法やディスク法に要する時間は,患者血液中の菌を検出するための血液培養,起炎菌の単離培養,そして薬剤処理条件で細菌増殖の有無を検出する培養ASTを合わせて,およそ3日間である。一方,適切な抗菌薬の投与までの時間が長くなればなるほど患者の生存率が低下すると報告されており7),培養を含めた検査全体の迅速化が課題となっている。
このような医療現場の課題に対し,日立はフランスのIHU(Institut Hospitalo-Universitaire Méditerranée Infection:地中海感染症研究所)のRaoult教授と,卓上SEMを用いて感染症の起炎菌がAMRを持つか否かを判定して治療に適した薬を選択するSEM-AST法を開発した8)。本手法では,抗菌薬処理した細菌をSEM画像分解能で観察することにより,抗菌薬投与直後にも生じる細菌形態の微小な変化の有無を検知する。つまり,従来法のように細菌の増殖時間を考慮する必要はなく,短時間の薬剤処理で,抗菌薬に対して菌が耐性か感性かを判定することが可能となる。
本研究では,細菌種として大腸菌(Escherichia Coli)を用い,抗菌薬イミペネム(以下,「IPM」と記す。)に対するASTを行った。あらかじめIPM感受性を従来法で確認した大腸菌株を,液体ミューラー・ヒントン培地(MH)で106~107 CFU/mlに調整し,Eucast MIC(Minimal Inhibitory Concentration) breakpoint濃度のIPMを投与して,攪拌しながら37℃で60分間インキュベートした。IPM処理後,細菌をガラススライド上に塗抹し,卓上SEMで低真空で観察して,SEM画像から細菌の幅を測定した。細菌の測定結果から,抗菌薬IPMがある状態とない状態ではIPM感受性菌株の細菌幅は大幅な増加を示した一方,IPM耐性菌株の細菌幅は変化しなかった(図3参照)8)。
耐性菌では,抗菌薬の有無に関わらず形態変化が認められなかったことから,感受性株に生じた形態変化は薬剤の影響であることが明らかである。IPMは,細菌の内膜のペニシリン結合タンパク質に影響を与え,細胞壁の合成を変化させ,細菌の超微細構造の形態変化を引き起こすことが報告されている9)。
本結果から,60分という非常に短いインキュベート時間でも細胞壁合成阻害による細菌の形態変化をSEMで捉えることにより,IPM感受性菌か耐性菌かを判断できた。
5. おわりに
本稿では,これまでSEMが用いられることがなかった腎生検や薬剤感受性試験でのSEMの応用事例を紹介した。
生物試料を電子顕微鏡で観察する多くの研究がこれまで報告されてきたが,電子顕微鏡自体が大がかりな装置であったために,臨床分野に使用される機会は少なかった。これに対し,金属蒸着など電子顕微鏡特有の前処理が不要でかつ卓上に設置可能な卓上SEMの登場により,臨床分野において診断に必要な情報を迅速に提供できる可能性が広がった。今後も引き続き,さまざまな症例での応用可能性を追求していく。
謝辞
本稿で述べた腎生検の研究において,鳥取大学医学部解剖学講座の稲賀すみれ講師に協力いただいた。また,細菌検査の研究においては,フランスのIHUのDidier Raoult教授をはじめとする関係各位より多くの支援を頂いた。深く感謝の意を表する次第である。
参考文献など
- 1)
- 渡邉俊哉:走査電子顕微鏡の原理と応用(観察,分析),精密工学会誌,Vol. 77, No. 11, pp. 1021~1026(2011.11)
- 2)
- S. Inaga et al.: Low vacuum scanning electron microscopy for paraffin sections utilizing the differential stainabilty of cells and tissues with platinum blue, Archives of histology and cytology, Vol. 72, No. 2, pp. 101-106(2009.7)
- 3)
- S. Inaga et al.: Rapid three-dimensional analysis of renal biopsy sections by low vacuum scanning electron microscopy, Archives of Histology and Cytology, Vol. 73, pp.113-125(2011)
- 4)
- J. C. Jennette et al.: Heptinstall’s Pathology of the Kidney 7th ed., Wolters Kluwer Health(2014.8)
- 5)
- J. O’Neill: Tackling drug-resistant infections globally: Final report and recommendations, The review on antimicrobial resistance (2016.5)
- 6)
- A. Åkerlund et al.: EUCAST rapid antimicrobial susceptibility testing (RAST) in blood cultures: validation in 55 European laboratories, Journal of antimicrobial chemotherapy, Vol. 75, No. 11, pp. 3230-3238(2020.11)
- 7)
- A. Kumar et al.: Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock, Critical Care Medicine, Vol. 34, No. 6, pp. 1589-1596(2006.6)
- 8)
- G. Haddad et al.: Rapid Detection of Imipenem Resistance in Gram-Negative Bacteria Using Tabletop Scanning Electron Microscopy: A Preliminary Evaluation, Frontiers in Microbiology, Vol. 12, No. 658322(2021.6)
- 9)
- R. J. Williams et al.: Mechanisms by which imipenem may overcome resistance in gram-negative bacilli, Journal of antimicrobial chemotherapy, Vol. 18, pp. 9-13(1986.12)








